PHYSIOLOGIE DE LA PLONGÉE
"L'ennemi du scaphandrier, c'est l'air qui le fait vivre en plongée"
Citation de Paul Bert
INTRODUCTION
L’incidence de la pression quant à l’apparition de certaines lésions a été constatée assez tôt dans l’histoire. On trouve par exemple des textes remontant à 1670 qui décrivent les travaux de Boyle à partir de l’utilisation de la pompe à vide inventée par l’allemand Von Guericke. 0euvrant avec des sujets non vivants puis divers animaux, Boyle soumit divers cobayes à des variations de pression. En autre, il constata qu’une vipère se débattait furieusement ; elle présentait de remarquables bulles dans les liquides et diverses parties de son corps. On a là un des premiers accidents de décompression enregistré dans la littérature. Mais Boyle fut loin de relier les accidents aux gaz inertes contenus dans l’air, et surtout à l’azote ; de ce fait l’apparition de bulles, simple curiosité scientifique, fut promptement négligée.
RELATIONS ENTRE PRESSION, VOLUME ET DENSITÉ
La pression atmosphérique au niveau de la mer est relativement constante (1bar). Dans l’eau, la pression s’accroit de 1 bar de pression relative tous les 10 mètres. Cela veut dire qu’à une profondeur de 10 mètres, la pression totale ou pression absolue, qui s’exerce sur le plongeur est de 2 bar, 1 bar de pression de l’eau et 1 bar de la pression de l’air. Cette pression s’exerce sur les réservoirs d’air souples, les comprimant et en réduisant leur volume. La réduction volumique de la poche d’air est proportionnelle à la pression.
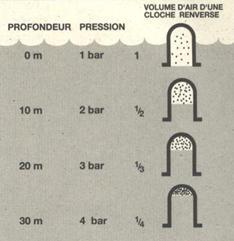
Quand un volume d’air contenu dans un récipient est réduit par compression, la densité de l’air augmente puisqu’il se trouve comprimé dans un espace plus réduit. Il n’y a pas donc de perte d’air malgré les apparences, ce dernier est simplement comprimé. La densité de l’air est ainsi proportionnelle à la pression.
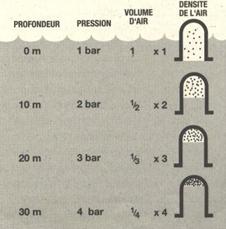
Dans un récipient souple, pour maintenir un certain volume à sa valeur d’origine, quand la pression augmente, il faut ajouter de l’air dans le récipient.
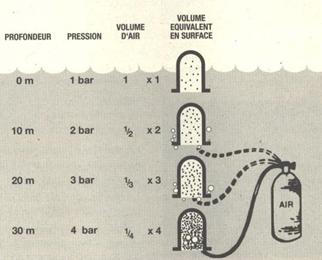
Au contrario, l’air contenu dans le récipient se dilate quand la pression diminue. Si l’on n’a pas ajouté de l’air dans le récipient, l’air qu’il contenait reviendra simplement au volume d’origine en se dilatant, au moment ou le récipient atteindra la surface.
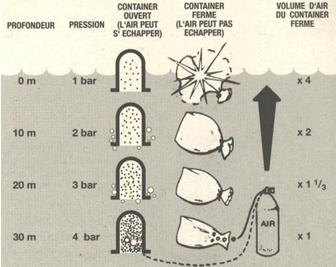
Si on a jouté de l’air dans le récipient pour compenser les effets de la pression, cet air se dilatera aussi avec la diminution de pression qui accompagne la remontée. Dans un récipient ouvert, le trop plein dilaté s’échappera simplement sous forme de bulles. Si maintenant l’air est contenu dans une enveloppe souple, le volume de celui-ci augmente lorsque la pression diminue. Si le volume vient à dépasser la capacité de l’enveloppe, celle-ci éclate sous l’effet de la dilatation de l’air.
CONSÉQUENCES DE L’AUGMENTATION DE PRESSION
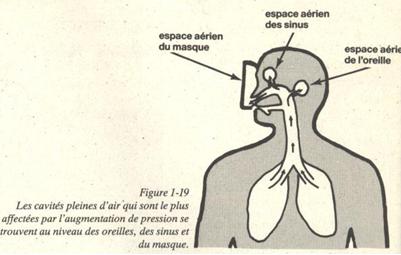
Pendant la descente, la pression hydrostatique augmente et comprime les cavités anatomiques si ces dernières ne sont pas maintenues en équipression avec la pression ambiante. La sensation qui en résulte est d’abord la gène et ensuite la douleur si vous continuez à descendre. Cette sensation est due à un écrasement mécanique ou barotraumatisme. Les barotraumatismes peuvent survenir en plusieurs endroits : oreilles, sinus, dents, poumons et enfin au niveau des yeux par le placage du masque.
L'ivresse des profondeurs, extrait du "Monde du Silence" du commandant Cousteau , source http://www.cousteau.org
LES MALADIES DE DÉCOMPRESSION
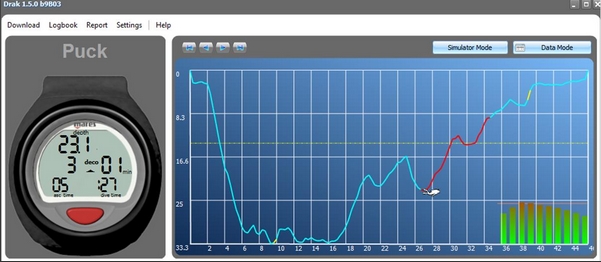
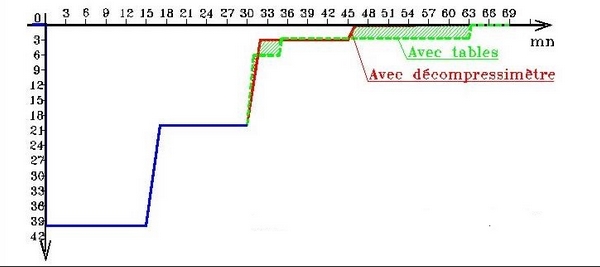
Au cours de la plongée, l’augmentation de pression amène l’azote de l’air respirable contenu dans les bouteilles ou envoyé au scaphandrier à se dissoudre dans les tissus du corps, on dit que les tissus se saturent en azote. Le volume de ce gaz, que notre corps est capable d’absorber pendant une plongée déterminée, dépend de la profondeur atteinte, et du temps passé à cette profondeur. Donc plus vous plongez profond et plus vous rester longtemps, plus votre corps absorbe de gaz. Autrement dit, plus il sature en azote. Lorsque l’on remonte, la pression ambiante diminuant, l’azote dont vous étiez saturé commence à se dégager de vos tissus, que l’on dit alors être sursaturés, c'est-à-dire que la tension d’azote qui y règne est supérieure à la pression ambiante. Ce dégazage de l’azote excédentaire doit s’opérer en douceur par la respiration puisque le corps n’utilise pas l’azote contrairement à l’oxygène. Ce qui est entré doit donc sortir. Tant que le volume d’azote en excès reste dans des limites acceptables, votre organisme peut l’éliminer sans complications, dans le cas contraire, le gaz excédentaire commencera alors à former des bulles dans les vaisseaux sanguins et dans les tissus au moment de la remontée. Les bulles provoquent un état physiologique très grave que l’on appelle maladie de décompression. Les symptômes sont les suivants : paralysie, état de choc, asthénie, vertiges, engourdissements, picotements, difficultés respiratoires, etc.…
Photo : Bulles dans des fibres musculaires

Maladie de décompression & caisson, extrait du "Monde du Silence" du commandant Cousteau, source http://www.cousteau.org
SURSATURATION CRITIQUE, PRESSION AMBIANTE TOLÉRÉE
A la fin du séjour au fond, et en fonction de leur période respective, tous les tissus se sont chargés en azote. A la remontée, il y a un moment ou la tension d’azote de certains tissus excède la pression partielle d’azote de l’air inspiré. Dès ce moment, ces tissus sont en sursaturation.
Sur la base de plongées réelles et d’essais en caisson hyperbare on a constaté que tous les tissus de notre corps supportent sans dommage, une certaine sursaturation. Des tests complémentaires ont mis en évidence que si cette sursaturation augmente trop, il y a formation de bulles gazeuses entraînant l’apparition de symptômes caractéristiques de l’accident de décompression. La limite de sursaturation tolérable avant le début de l’accident s’appelle la sursaturation critique. Les tissus ayant des périodes courtes tolèrent une sursaturation supérieure à ceux qui ont des périodes plus longues. Ce qui veut dire que les organes richement vascularisés acceptent une sursaturation plus grande que ceux moins vascularisés. La tension d’azote maximum tolérée par un tissu s’appelle : « tension critique » et elle dépend de la période du tissu.
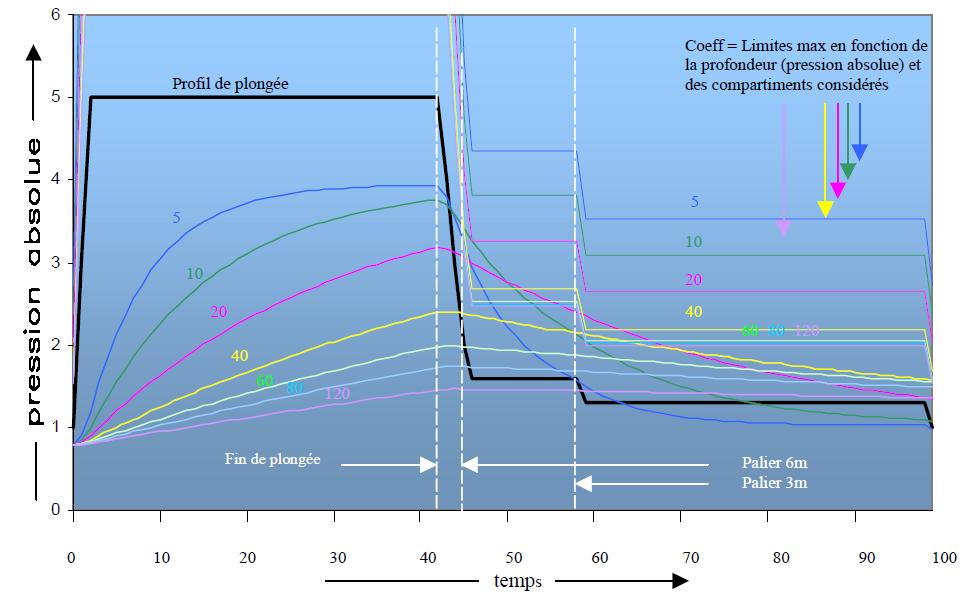
SATURATION ET DÉSATURATION
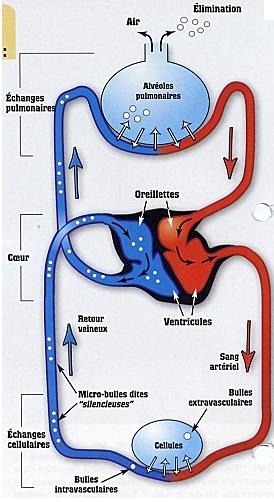
Sous l’eau, nous savons que nous devons respirer de l’air à la pression égale à celle que nous subissons. Nous savons que notre sang est en contact avec cet air sous pression par l’intermédiaire des poumons (alvéoles) et que le système cardio-vasculaire transporte le sang dans toutes les parties de l’organisme. Enfin, nous savons que plus la pression est grande, plus la quantité d’azote dissoute sera grande aussi (loi de Henry).
A la descente et pendant la plongée, de l’azote va se dissoudre dans notre corps.
A la remontée, cet azote dissous va vouloir ressortir de notre corps...
Physiologie I
Physiologie II
Physiologie III